○小池晃君 日本共産党の小池晃です。
今回の薬事法改正案の出発点をまずやっぱり考えたいと思うんですが、薬害肝炎検証再発防止委員会の最終提言で事件の反省と再発防止を確認して、それを受けた法改正であったはずです。今大臣も、本来は、そういう点でいえば第三者組織の設置を、その法案を一緒に出すべきだったというふうに率直におっしゃいました。私もそうだと思うんですね。
〔委員長退席、理事古川俊治君着席〕
この第三者組織の法案については、これは肝炎原告団と国との約束でもあるし、歴代大臣も繰り返しこれは言明してきたことです。それがやはり一緒に行われなかったということは、私はこれはそもそもの法の前提を欠くものではないかというふうに思うんですが、大臣、いかがですか。
○国務大臣(田村憲久君) 第三者組織に関しましては、先ほど、私も自ら議員連盟のメンバーで、その思いの中でお話をさせていただいたわけでありますけれども、それはできればこの薬事法改正とともに何とか成立させたいというふうな思いがございました。
ただ、当初、閣法というものでこれを出すことに対していろんな制約があって、なかなかうまい知恵が絞れなかったということもございました。議員立法自体は、これはやはり原告団の皆様方の思いの中で、やはりこれは政府が出してもらいたいというような思いがありました。そういう中でいろいろと一致点を探りながら進めてまいったわけでありますけれども、どうしても幾つかのハードルが乗り越えられない中において時間切れになってしまったということでございます。
一方で、やはり今回の薬事法の改正、これ自体はやっぱり時間迫られるものでございまして、そういう意味からいたしますと、これが先に今国会で御議論をいただくわけでありますけれども、この第三者組織に関しましても、早くそれぞれ関係の皆様方との一致点を見出して実現に向かって前向きに努力をしてまいりたい、このように思っております。
○小池晃君 早くつくりたいということは、もう本当にそういう方向で私どもも努力したいと思います。
その点で、つくりたい、早くつくりたいという第三者組織、この中身ですが、やはり厚労省からの独立性、事務局の設置、実効性のある調査権限というのは私はどうしても必要だと思いますが、大臣はいかがお考えですか。
○国務大臣(田村憲久君) 独立性、専門性、機動性というものが必要だというふうに思っております。その中で独立性の中に関しても実はその議論の中でいろんな意見の違いがあって、その中で今般は法律提出ができなかったというところがあるわけであります。
事務局の問題もやはりこれも一つ大きな課題であろうと思いますし、調査権限の話でありますが、これも実質的には担保できるんでありましょうけれども、法律の書き方としてなかなか難しいところがあるというような幾つかのハードルがまだ残っているんです。残っておりますけれども、そこを何とか、それぞれの関係者、それこそ折り合いを付けて、これが形にならないかということでいろいろと悩んでおるわけでありまして、早く一致点を見出してまいりたい、このように思っております。
○小池晃君 これはやはり党派を超えて実現する責任を果たしていかなければいけないというふうに思います。
添付文書についてお聞きします。
添付文書の記載不備に起因する薬害というのは相次いでいるわけです。例えばソリブジン事件ではフルオロウラシル系の抗がん剤との併用の危険性に関する記述が不十分で、発売後一か月で十五名の死亡を出しています。薬害イレッサ事件でも間質性肺炎の副作用の記載が不十分で、発売後二年間で五百五十七名という被害を出しています。
局長にお聞きしますが、こうした経過も踏まえて、肝炎検証再発防止委員会の最終提言では、添付文書について、「欧米の制度も参考に、承認の対象とするなど承認時の位置付けを見直し、公的な文書として行政の責任を明確にする」という提言を行っております。ところが、承認事項ではなく届出事項になった、それはなぜでしょうか。
○政府参考人(今別府敏雄君) 添付文書につきましては、厚生科学審議会の医薬品等制度改正検討部会におきまして、承認制とした場合に改訂のための承認審査に一定の時間を要することから、リスクに柔軟かつ臨機応変に対応できないおそれがあるのではないかとか、現場の医師は使用上の注意以外の使用方法では使用しない等の萎縮が起こるなど、医師の裁量を狭め、患者の医薬品アクセスを狭めるおそれがあるのではないかという意見が多かったと聞いております。
一方、検討部会では、届出制であっても、国が改善命令を出す権限が明確であれば、承認制と届出制とで国の責任に大きな違いはないのではないかとの考え方から、製造販売業者に添付文書の作成案又は改訂案を厚生労働大臣にあらかじめ届け出る義務を新設をするということが適当であるという意見が多かったと、こうした意見を踏まえまして、届出制としたものでございます。
○小池晃君 時間が掛かるというお話ありましたけれども、使用上の注意を用法、用量と同じ位置付けにしなくても、これは安全上の観点から行う変更については現行法でも軽微な変更というような仕組みはあるわけですから、やっぱりそういった形で薬事法上も規定すればクリアできたと私は思うんです。そもそも使用上の注意を改訂する際に、届出事項にする場合と承認事項にする場合で、申請者側に要求されるデータというのは違いが何かあるんでしょうか。
○政府参考人(今別府敏雄君) 添付文書につきましては、臨床試験や市販後の副作用情報などの根拠となる資料を提出をさせまして、記載の内容を確認しております。法律の改正後も必要となる資料やデータの範囲に承認制と届出制で違いはないものと考えております。
○小池晃君 だとすれば、やはりきちっと承認事項にすべきだと思うんですね。
それから萎縮をすると、医療現場が萎縮するという、先ほどそういう議論がありました。お聞きしたいんですが、承認事項とした場合の法的効果というのは、それはその医薬品を使用する医師まで法的効果は及ぶんでしょうか。
○政府参考人(今別府敏雄君) 添付文書の作成、改訂が承認制か届出制かのいずれかでありましても、法律上は医師が添付文書の記載内容に必ず従わなければならないという法的効果が生じるものではありません。
○小池晃君 これは萎縮するというのは私、説得力ないと思うんですね。現実に、もう既に用法、用量、効能、効果というのは現在も承認事項だけれども、医師が自分の裁量権で適用外使用するということは現場では起こっているわけで、承認事項にすると萎縮するというより、私は、萎縮するのは医師ではなくて医薬品行政や製薬企業ではないかというふうに思うんです。やはり今のお話を聞いても、私は承認事項とせずに届出事項にとどまったということは不適切だというふうに思います。
さらに、制度改正検討部会の取りまとめは、仮に届出義務にしたとしても、その場合は改善命令等是正権限の明確化、申請時の添付文書案の提出義務を課すべきだと言っていました。
それ何でしなかったんですか。
○政府参考人(今別府敏雄君) 改善命令は現行法でも対象にできるということでございます。それから、添付文書案の提出義務につきましては、申請時に添付が義務付けられている資料が法律の規定に基づいて省令で定められておりますので、改正法の施行までにこの省令を改正して、提出すべき資料に添付文書案を追加するということにしようと考えております。
○小池晃君 今、法律も、先ほども議論ありましたけれども、確認しますが、現行薬事法七十二条の四第一項の「業務の運営の改善に必要な措置」の中に添付文書の改訂は含まれるんですね。お答えください。
○政府参考人(今別府敏雄君) 御指摘のとおりでございます。
○小池晃君 以上を踏まえて大臣にお聞きしますが、今もちょっとお話ありましたが、現行薬事法でも通知によって申請時に添付文書案の提出を求められているわけです。業者はその内容を事実上審査をしていると言ってもいいと思うんですね。にもかかわらず、最終提言が添付文書を公的な文書として行政の責任を明確にするようにと言ったのは、やはりその添付文書に関する行政の責任を薬事法上明確に位置付けることによって行政の権限行使をより明確にすることを求めたものだと思うんです。これはまさに過去のいろんな事件の教訓を踏まえたものだと私は思います。しかし、今回それが行われないまま提案をされています。
大臣、今回の法案は、やはり承認事項にすべきとした最終提言あるいはそれに準ずる改正を要求した制度改正検討部会の取りまとめのその求めに反するものだと私は思いますが、大臣、いかがですか。
○副大臣(土屋品子君) 医薬品の承認申請時の添付文書案の提出や市販後の添付文書の改訂等については、これまで国では通知を根拠に指導してまいりました。薬害肝炎検証・検討委員会の最終提言では、添付文書に対する国の責任を明確にすることが求められていますが、今回の改正により、製造販売業者に対して薬事法に基づく国への添付文書の届出を義務付けることとしていることから、国の関与、責任も明確になっており、最終提言に沿ったものになっていると考えております。
あわせて、PMDAの安全対策部門の強化を図るなど、添付文書の記載内容についての適切な指導等を行うこと等により関係者の理解を得られるようにしていきたいと考えております。
○小池晃君 答弁要求、副大臣に出していませんから、私。これ理事会で確認していますから。別に副大臣が嫌いだとかそういうわけじゃないですけどね。大臣にと言っていますから、全部局長に聞いてから大臣に一問だけ聞いているんだから、大臣、このぐらい答えてくださいよ。ちょっと、もうこれ以上駄目ですからね。ちゃんとやっぱりやっていただきたい。
〔理事古川俊治君退席、委員長着席〕
それで、ディオバンのことを次にお聞きしたいんですが、ノバルティスファーマ社が販売した高血圧治療薬ディオバンのデータ改ざんは、これは本当に我が国の医薬品の臨床研究への信頼を失墜させることになったと思います。真相の徹底解明と再発防止が必要です。
ノバルティス社は医師向けの情報誌に、改ざんされたデータに基づいて、心血管イベントの抑制効果があるということを医師の座談会などの形で宣伝をしておりました。
局長、薬事法第六十六条は虚偽、誇大広告を禁止しておりますが、ここで言っている広告とはどういうものでしょうか。
○政府参考人(今別府敏雄君) この薬事法六十六条に基づく医薬品等の広告の監視指導につきましては、個別の広告資材を全体として見て、顧客を誘引する意図が明確であるか、特定医薬品等の商品名が明らかにされているか、一般人が認知できる状態であるかという三つの要件を満たす場合に薬事法の規制対象となる広告として監視指導を行っております。
○小池晃君 例えば医師向け雑誌の座談会、インタビュー形式による記事などで医薬品会社が提供する形で行われるものは、薬事法六十六条でいう広告に当たるんでしょうか。
○政府参考人(今別府敏雄君) 個別の広告資材について精査をいたしまして、先ほど申し上げました三要件を満たすというものであれば、薬事法六十六条の規制対象になると考えております。
○小池晃君 特定医薬品の商品名が明らかにされていると先ほどおっしゃいました。これは、商品名記載されていなくても、それが類推されるものも含まれるという理解でよろしいでしょうか。
○政府参考人(今別府敏雄君) 必ずしも特定の医薬品の名称が出ていない場合であっても、その事実をもって直ちに薬事法の規制対象外としているわけではございません。
○小池晃君 大臣、こういう記事形式の広告というのは非常に広く行われているんですね。ある意味では、その添付文書より医者はそういうのを見て薬の使用を決めるというのが実態なんですよ。
WHOというのは、この規制の対象を広告ということに限定しないで、広くプロモーションというような考え方で、医薬品製造業者及び販売業者に、処方、供給、売買及び使用を勧誘する全ての情報通知や説得行為というふうにプロモーションを定義して、そうしたことを、科学的、教育的活動を故意に宣伝目的に利用してはならないというようなことも言っていまして、やっぱりこういうディオバンの経過も踏まえて、新たなやっぱり法的な規制の枠組みというのも考える必要があるんじゃないかと私は思うんですが、いかがでしょうか。
○国務大臣(田村憲久君) いろんな広告の様態といいますか、様々なものが出てきているのは確かであります。一方で、やはり医薬品の適正使用というその必要性も迫られるわけでありまして、これは自主的なルール、業界の、これもひとつお作りをいただきたいと思うとともに、やはり一方で何らかの対応を行政としてしなければならないのかなというような、そんな感覚を持っております。
今、ちょうど例のディオバンの関係で中間報告が出てまいりまして、ここでもこの議論をしていただきました。こういう議論を踏まえながら、適切な対応をしてまいりたいというふうに思います。
○小池晃君 さらに、臨床研究の法制化について聞きますが、ディオバンのデータ捏造事件では、治験には法律の規制があるけれども、治験以外の臨床試験には法律に基づく事前届出制、審査などを求める制度はないということが問題になりました。
医政局長に聞きますが、現行法では治験に対しては規制が行われておりますが、なぜ発売後の臨床研究には必要とされていないのか、その理由をお示しいただきたい。
○政府参考人(原徳壽君) そもそも治験は、薬事法において医薬品等の承認申請に必要な臨床試験の試験成績に関する資料の収集を目的とする試験の実施と定義付けられております。
一方、臨床研究につきましては、薬事法のこれらの規定にかかわらず、幅広く人を対象として行われる医学系研究を含むものでございます。このため、医薬品や医療機器を用いる研究も含まれますが、治験とは目的が異なるものであると考えております。
なお、治験以外の臨床研究につきましては、臨床研究に関する倫理指針により、被験者保護等の観点から、臨床研究の実施に当たり研究者等が遵守すべき基本原則を示しているところでございます。
○小池晃君 ICH三極で治験以外の臨床研究を法的規制していないのは日本だけなわけですよ。アメリカもEUもやっているわけですね。医薬品開発を成長戦略に位置付けるというのであれば、私は欧米並みの法的規制こそ急務ではないかというふうに思うんです。
大臣、この臨床研究の法制化というのは、これは日本の臨床研究に対する国際的信頼にもかかわる問題であると思いますし、何よりも治験と比べて被験者の権利保護という点では何の違いもないわけですよ。
そういう点でいえば、やはりこれは臨床研究、法制化に踏み切るべきだと思いますが、いかがですか。
○国務大臣(田村憲久君) どこまでの臨床研究なのかという問題一つあると思いますが、これも中間報告、取りまとめの中で、被験者の保護もそうでありますし、そもそも臨床研究の質の確保、信頼性という面から法制化をすべきだという意見もあるわけであります。一方で、やはりそれだけの人員確保しなきゃなりませんから、それなりに費用も掛かると。それ自体が臨床研究を進めるに当たって、ある意味、何といいますか、抑制が掛かってしまうおそれもあるねというような御議論もいただいております。
いずれにいたしましても、これは一つ大きな問題だと思いますので、来年の秋ぐらいまでに検討して、一定の方向性どうするかということを決めてまいりたい、このように思っております。
○小池晃君 費用の問題という議論がありました。
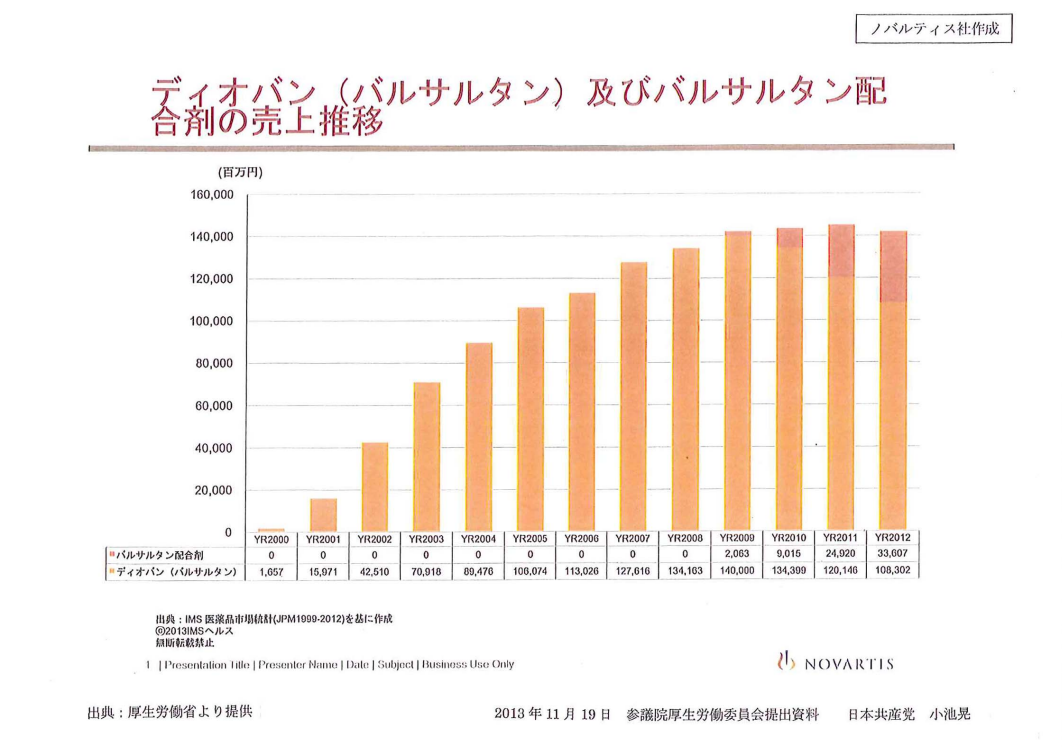
医政局長にお聞きしますが、発売以来の国内でのディオバン及びバルサルタン配合剤の売上げの総額は幾らでしょうか。
○政府参考人(原徳壽君) 個別の医薬品の販売量についての調査はしておりませんが、ノバルティス社の公表資料では、販売を開始した二〇〇〇年から二〇一二年までのディオバンの売上高は、配合剤を含めて国内で約一兆二千七百三十九億円と認識しております。
○小池晃君 配付資料にグラフも出しております。毎年一千億円以上の売上げを上げるいわゆるブロックバスターという、そういう薬剤なわけです。もちろん、私はこの一兆円の売上げが全て不正なものだとは言いません。しかし、やはりその不正なデータによってこれを使用するということに至ったという経過もこの中にはかなり含まれていることは間違いないと思うんですね。
私は、費用の問題でいえば、こうしたものをやっぱり社会に還元させていく、そういう必要性を感じるわけですよ。私は、それ、費用をつくるというだけじゃなくて、やっぱり日本の臨床研究のゆがみを正すという上でも重要なのではないかと。
例えばディオバンの問題では、ノバルティス社から京都府立医大に、研究室に三億八千万円、慈恵医大には一億九千万円の奨学寄附金が注がれているということであります。医師主導の臨床研究に対する医師主導の臨床試験というのは、これは企業の意向に左右されずに医学的に必要な試験を行うということに意義があったのに、そうなっていないという実態があると思うんですよ。
大臣、やっぱり、もちろん政府による公的な臨床研究に対する財政支援も必要ですけれども、こういう特定の企業による奨学資金というような形でのお金の流れ方ではなくて、もっと公正で透明な公的な基金みたいなものをつくって、製薬企業にこういう拠出をさせていくような形で薬剤の臨床研究を進めていくということも考えていいんじゃないかと。
朝日新聞のまとめでは、二〇一二年度に製薬企業が大学などに払った総額は十七社で、一社当たり百億円を超えて、これだけで総額三千億円に上ると。これだけのお金が特定の企業の特定の薬剤を研究している研究室に出ているという仕組みをやっぱり正して、自社製品のためだけではなくて、日本の医薬品研究のために拠出させるような、そういう仕組みというのを考えていく必要があるんじゃないかと、このディオバンの事件を契機に、そういうふうに考えるんですが、大臣、いかがでしょうか。
○大臣政務官(赤石清美君) お答え申し上げます。
ディオバンの売上げをどうとらえるかについては、検討会の中間とりまとめにおいて、今回の事案にかかる臨床研究による医療保険財政への影響の評価等について検討すべきと指摘をされております。この取りまとめを踏まえて、現在、今後の対応方針も含めて精査をしているところでございます。
○国務大臣(田村憲久君) 質問が二問あったような気がいたしましたので。
今言われたような奨学寄附金でありますとか委託研究、こういうようなものも、民間それから公の研究費含めてやはり臨床研究をする中において重要なこれは財源であることは間違いないわけであります。
今委員が言われたような基金みたいな話でありますけれども、今も実際問題、研究者や研究機関等々を公募で選んで、そこで研究費用を出しているということもあるわけでありまして、そういう意味では近いような考え方だというふうに思いますが、奨学寄附金にいたしましても委託研究にしましても、問題はやはりちゃんと情報が開示されていることだと思います。そこにお金が入っているということになれば、そこはしっかりとしたチェックが入るわけでありまして、お金が入っているかどうかよく分からないというところに、どうもどういう関係でそのような結果が出てきたのかということに対しての透明性がなくなるわけでございまして、そこはそこでしっかりとした対応をさせていただきたいと、このように思っております。
○小池晃君 これは、やはり今回の経験を踏まえて前向きに検討していくべき課題だというふうに思います。
それから、再生医療について一問聞きたいんですが、特定認定再生医療委員会、これについては実施医療機関の外に独立した公的審査機関として設置すべきではなかったかというふうに思うんです。ディオバン事件でも、やはりその倫理委員会が全く機能していないということも明らかになったわけで、そういう点では、そういうことはなぜしなかったのかということについてお伺いしたい。
○大臣政務官(赤石清美君) お答えいたします。
この特定認定再生医療等委員会は、第一種及び第二種再生医療等について十分な知見を有する専門家を委員とすることが必要なため、その知見を有すると考えられる病院等に設置できることとしております。
御指摘いただいたとおり、特定認定再生医療等委員会については、公正な審査を実施できるよう高い第三者性を要件とする必要があるため、外部委員を複数とすることなどの構成要件を検討しており、また、全国で十ないし十五か所程度とすることを想定しております。さらに、法律上、審査が適正に行われていない場合は改善命令や認定の取消しの規定を置くことにより、自施設の計画を審査する場合でも適切な審査が可能な委員会となるようにしていくこととしております。
以上です。
○小池晃君 そんなにあれこれ言うんだったら、実施医療機関の外につくった方がすっきりするんじゃないかと私は思いますけれどもね。まあそれぐらいにしておきます。
ネット販売のことをちょっと最後に。
最高裁判決が私は誤って報道されていると思うんですよ。あの最高裁判決というのは、医薬品のネット販売そのものを、是非に対する司法判断ではないと思いますが、そういう理解でよろしいですね。
○政府参考人(今別府敏雄君) 委員御指摘のとおり、本年一月の最高裁判決では、第一類、第二類医薬品のインターネット販売を禁止する省令について、これを一律に禁止することとなる限度において現行の薬事法の委任の範囲を逸脱した違法なものとして無効と判断をされたものでございます。
最高裁判決では、政府部内においてすら一般医薬品の販売方法を対面販売に限定すべき理由には乏しいとの見解が根強く存在をしていたこと、インターネット販売の禁止はインターネット販売をその事業の柱としてきた者の職業活動の自由を相当程度制約するものであることという事実関係は述べておりますけれども、インターネット販売の是非については何らの判断も示していないと考えております。
○小池晃君 もう質問はこれで終わりにしますが、だから、結局、あの最高裁判決はインターネット販売を規制するようなものじゃないんですよ。要するに、薬事法の委任の範囲を超えているというだけなんですよ。だから、今度の閣議決定された法案でも医療用医薬品は対面販売というふうにしたわけでしょう。これで最高裁判決にこたえているわけですよ。だったら、何で一、二類はネット解禁なんですかと。一、二類だって対面販売禁止ということを薬事法に書き込めば最高裁判決の趣旨に私こたえることになったというふうに思うんですね。
これは私も実際この委員会で川崎二郎大臣のときに質問して、一類医薬品がネットで販売されているじゃないかということを指摘をしたらば、それは薬事法を改正してきちっと強制力を持ってやれるようにするんですというふうに答弁して、まだそれから五年しかたっていないんですね。それでこうがらっと、何だか一業者から言われたからって政策方針変えてしまうというのは、私はこれ、どう考えてもおかしいと。こんなことでは国民の命は守れませんということは、ちょっと今日はその法案じゃないので、またこれからあるかもしれませんので、一言言っておきます。
終わります。
閉じる